El argón es el gas inerte más comúnmente utilizado en cajas de guantes y líneas Schlenk para experimentos altamente sensibles. Aunque el nitrógeno es una alternativa menos costosa y más frecuente, el argón se prefiere estrictamente cuando existe algún riesgo de que el gas "inerte" reaccione con los materiales experimentales, lo que puede ocurrir con ciertos metales o a altas temperaturas.
La elección entre argón y nitrógeno es una decisión crítica en la química sensible al aire, ya que equilibra el costo con la pureza química. Si bien el nitrógeno es un caballo de batalla rentable, el argón proporciona un nivel superior de inercia, actuando como un seguro esencial para experimentos altamente reactivos o a alta temperatura.

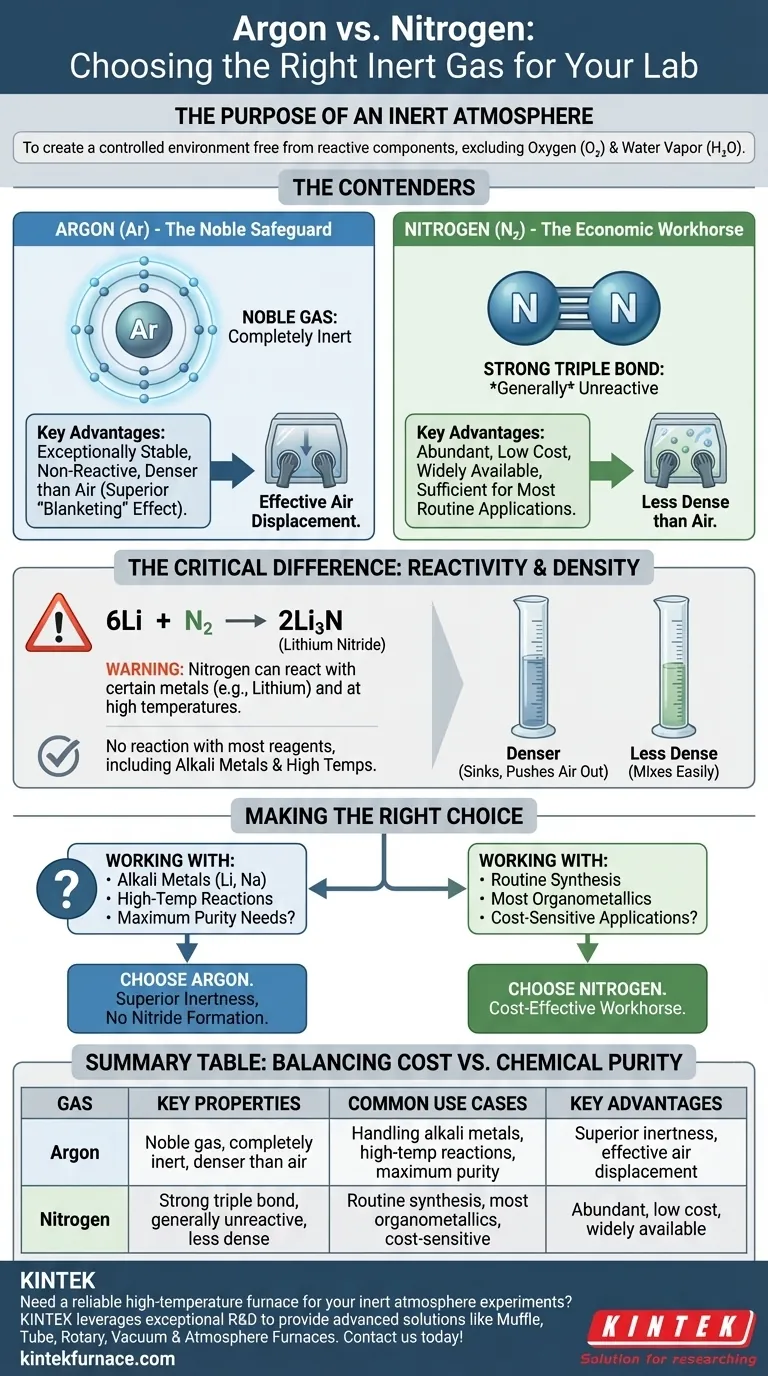
El propósito de una atmósfera inerte
La función principal de una caja de guantes o una línea Schlenk es crear un ambiente controlado libre de componentes atmosféricos reactivos. Los principales culpables que se intenta excluir son el oxígeno (O₂) y el vapor de agua (H₂O), que pueden descomponer fácilmente reactivos y catalizadores sensibles.
Se utiliza un gas inerte, como el argón o el nitrógeno, para desplazar el aire y mantener una presión positiva, evitando que las fugas atmosféricas entren en el sistema.
Comparando los contendientes: Argón vs. Nitrógeno
Si bien ambos se utilizan para crear una atmósfera inerte, sus propiedades químicas y físicas dictan cuándo uno es una mejor opción que el otro.
Nitrógeno: El caballo de batalla económico
El nitrógeno (N₂) constituye alrededor del 78% del aire que respiramos y, por lo tanto, es abundante y económico.
La molécula de N₂ se caracteriza por un enlace triple muy fuerte entre sus dos átomos de nitrógeno. Este enlace requiere una cantidad significativa de energía para romperse, razón por la cual el nitrógeno es generalmente no reactivo y adecuado para una amplia gama de aplicaciones químicas.
Argón: El resguardo noble
El argón (Ar) es un gas noble. Esto significa que sus átomos tienen una capa de electrones externa completamente llena, lo que lo hace excepcionalmente estable y no reactivo.
Bajo prácticamente todas las condiciones de laboratorio, el argón no formará enlaces químicos ni reaccionará con sus reactivos. Esta inercia química fundamental es su mayor fortaleza.
La diferencia crítica: Reactividad
El término "inerte" es relativo. Si bien el nitrógeno es mayormente no reactivo, no es completamente inerte.
Bajo ciertas condiciones, el nitrógeno puede reaccionar con ciertos metales para formar nitruros metálicos. El ejemplo más común en química sintética involucra al litio metálico, que reacciona fácilmente con el gas N₂ incluso a temperatura ambiente para formar nitruro de litio (Li₃N).
6Li + N₂ → 2Li₃N
Esta reacción secundaria no deseada puede consumir su reactivo e introducir impurezas. Reacciones similares pueden ocurrir con otros metales alcalinos, metales alcalinotérreos o durante síntesis realizadas a altas temperaturas. El argón, como gas noble, no tiene esta vulnerabilidad.
Una consideración práctica: Densidad del gas
Una diferencia física clave es la densidad. El argón es aproximadamente un 40% más denso que el aire, mientras que el nitrógeno es ligeramente menos denso que el aire.
Esto significa que el argón es más eficaz para desplazar el aire de un recipiente, ya que se "hundirá" y empujará el aire más ligero hacia arriba y hacia afuera. Este efecto de "manto" lo hace superior para purgar cristalería en una línea Schlenk y mantener una atmósfera estable dentro de una caja de guantes, ya que se asienta en el fondo en lugar de mezclarse fácilmente.
Comprender las compensaciones
Elegir el gas correcto requiere equilibrar la seguridad absoluta con las restricciones prácticas.
Costo: El impulsor principal
La ventaja más significativa del nitrógeno es su bajo costo. El argón es sustancialmente más caro que el nitrógeno.
Para los laboratorios que operan muchas cajas de guantes o realizan síntesis a gran escala, esta diferencia de costo puede ser un factor importante. Por esta razón, el nitrógeno a menudo es la opción predeterminada para cualquier trabajo en el que su potencial reactividad no sea una preocupación.
Pureza y Suministro
Ambos gases están disponibles comercialmente en grados de pureza muy altos (por ejemplo, 99.999%). La diferencia clave a menudo radica en el método de suministro.
Los usuarios de nitrógeno a gran escala pueden tener generadores in situ o grandes bidones de nitrógeno líquido que proporcionan un suministro continuo de gas por ebullición, lo que reduce aún más su costo operativo. El argón casi siempre se suministra en cilindros de gas de alta presión, que requieren reemplazo regular.
Tomar la decisión correcta para su experimento
Su decisión debe basarse en la química específica que está realizando.
- Si su enfoque principal es la síntesis rutinaria, la purificación o la manipulación de la mayoría de los organometálicos: Use nitrógeno. Es lo suficientemente inerte para la gran mayoría de las aplicaciones y ofrece importantes ahorros de costos.
- Si su enfoque principal es trabajar con litio, otros metales alcalinos o realizar reacciones a alta temperatura: Use argón. Su inercia superior no es negociable y protege su experimento de la formación de nitruros metálicos no deseados.
- Si su enfoque principal es la máxima certeza y la eliminación de todas las variables: Use argón. El mayor costo es un pequeño precio a pagar por el seguro de que su gas inerte es verdaderamente inerte.
En última instancia, comprender la reactividad sutil del nitrógeno es lo que separa la práctica rutinaria del diseño experimental preciso y deliberado.
Tabla de resumen:
| Gas | Propiedades clave | Casos de uso comunes | Ventajas clave |
|---|---|---|---|
| Argón | Gas noble, completamente inerte, más denso que el aire | Manipulación de metales alcalinos, reacciones a alta temperatura, necesidades de máxima pureza | Inercia superior, desplazamiento efectivo del aire, sin formación de nitruros |
| Nitrógeno | Fuerte enlace triple, generalmente no reactivo, menos denso que el aire | Síntesis rutinaria, la mayoría de los organometálicos, aplicaciones sensibles al costo | Abundante, bajo costo, ampliamente disponible |
¿Necesita un horno de alta temperatura confiable para sus experimentos en atmósfera inerte? KINTEK aprovecha una excepcional I+D y fabricación interna para proporcionar soluciones avanzadas como hornos de mufla, de tubo, rotatorios, de vacío y de atmósfera, y sistemas CVD/PECVD. Con sólidas capacidades de personalización profunda, satisfacemos con precisión sus requisitos experimentales únicos. Contáctenos hoy para mejorar la eficiencia y seguridad de su laboratorio.
Guía Visual
Productos relacionados
- 1200℃ Horno de atmósfera inerte de nitrógeno controlada
- Horno de atmósfera controlada con cinta de malla Horno de atmósfera inerte de nitrógeno
- 1700℃ Horno de atmósfera de nitrógeno inerte controlada
- 1400℃ Horno de atmósfera de nitrógeno inerte controlada
- Horno de atmósfera controlada de nitrógeno inerte e hidrógeno
La gente también pregunta
- ¿Cómo funciona una atmósfera químicamente inerte en un horno? Prevenir la oxidación y asegurar la pureza del material
- ¿Qué significa inerte en las atmósferas de los hornos? Proteja los materiales de la oxidación con gases inertes.
- ¿Cómo funciona el tratamiento térmico en atmósfera inerte? Prevención de la oxidación para una calidad de material superior
- ¿Cómo mejora el tratamiento térmico en atmósfera de nitrógeno el endurecimiento superficial? Mejora la durabilidad y el rendimiento
- ¿Para qué se utiliza el nitrógeno en un horno? Prevenir la oxidación y controlar la calidad del tratamiento térmico



















